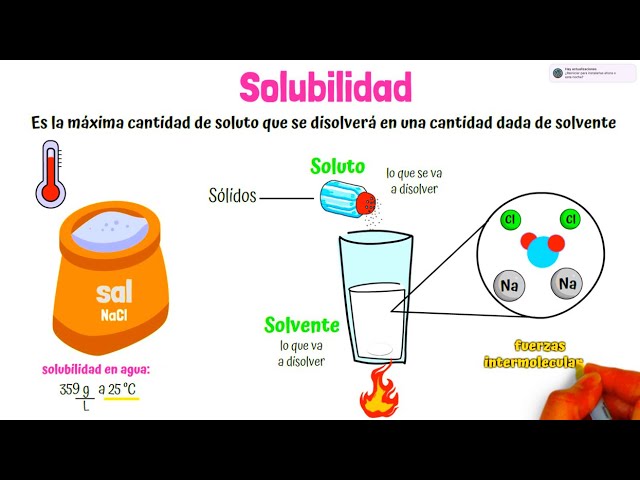
La solubilidad en agua es un tema fascinante que toca aspectos de la química, la biología y hasta la vida cotidiana. ¿Alguna vez te has preguntado por qué algunas sustancias se disuelven en agua mientras que otras no? Imagina que el agua es como un gran baile, donde algunas moléculas son excelentes bailarinas que se mueven al ritmo de la música, mientras que otras simplemente no pueden seguir el compás. En este artículo, exploraremos los factores clave que influyen en la solubilidad de las sustancias en agua y las explicaciones científicas detrás de estos fenómenos. Desde la naturaleza química de las moléculas hasta las interacciones entre ellas, desglosaremos todo lo que necesitas saber sobre este tema tan intrigante.
Factores que influyen en la solubilidad en agua
La naturaleza de las sustancias: polaridad y no polaridad
Una de las primeras cosas que debes entender sobre la solubilidad es la polaridad. Piensa en las moléculas como si fueran amigos en una fiesta. Las moléculas polares, como el agua, son como esos amigos que se llevan bien entre sí, mientras que las moléculas no polares son más como los que prefieren estar en su rincón, evitando la interacción. El agua es una molécula polar, lo que significa que tiene una distribución desigual de carga. Esto le permite atraer a otras moléculas polares y disolverlas fácilmente.
El famoso «principio de los semejantes»
¿Alguna vez has oído hablar del principio de «lo similar disuelve a lo similar»? Este es un concepto clave en la química que nos dice que las sustancias polares tienden a disolverse en otras sustancias polares, mientras que las no polares se disuelven en otras no polares. Por ejemplo, si intentas mezclar aceite (no polar) con agua (polar), es como intentar mezclar agua con aceite: no importa cuánto lo intentes, no se van a llevar bien. Esto se debe a que las fuerzas intermoleculares que mantienen unidas a las moléculas son diferentes y, por lo tanto, no pueden interactuar de manera efectiva.
Temperatura: el calor y su efecto en la solubilidad
La temperatura también juega un papel crucial en la solubilidad. Imagina que estás cocinando un poco de pasta. Si el agua está fría, es probable que la pasta no se cocine bien. Pero cuando calientas el agua, la pasta se cocina más rápido. Lo mismo sucede con las moléculas en solución. A medida que la temperatura aumenta, las moléculas de agua se mueven más rápido, lo que les permite interactuar más eficazmente con las sustancias que intentan disolver. Esto generalmente resulta en una mayor solubilidad de sólidos en líquidos a temperaturas más altas.
El caso del azúcar y la sal
Un buen ejemplo de cómo la temperatura afecta la solubilidad es el azúcar y la sal. Cuando añades azúcar a un vaso de agua caliente, se disuelve casi instantáneamente. Pero si lo haces en agua fría, puede tardar un poco más. En el caso de la sal, también se disuelve más rápido en agua caliente. Esto se debe a que el calor proporciona la energía necesaria para romper los enlaces que mantienen unidas a las moléculas de azúcar o sal, permitiendo que se integren en el agua.
La presión es otro factor que no siempre se considera al hablar de solubilidad, pero tiene un impacto significativo, especialmente en los gases. Imagina que estás tratando de inflar un globo. Cuanta más presión apliques, más aire puedes introducir en el globo. De manera similar, cuando aumentas la presión sobre un gas en un líquido, más gas se disolverá en ese líquido. Este fenómeno es especialmente relevante en bebidas carbonatadas, donde el dióxido de carbono se mantiene disuelto a alta presión, pero se libera cuando abres la botella y la presión disminuye.
La relación entre presión y solubilidad de gases
La ley de Henry nos ayuda a entender esta relación: la cantidad de gas disuelta en un líquido es directamente proporcional a la presión del gas en equilibrio con el líquido. Por lo tanto, si quieres que más gas se disuelva en un líquido, solo necesitas aumentar la presión. Este principio es esencial en diversas aplicaciones, desde la fabricación de refrescos hasta la medicina, donde la solubilidad de gases puede ser vital para la salud.
Interacciones iónicas y enlaces de hidrógeno
Las interacciones entre las moléculas también juegan un papel crucial en la solubilidad. Cuando hablamos de sustancias iónicas, como la sal, los enlaces iónicos se rompen cuando se disuelven en agua. Esto se debe a que las moléculas de agua, con su polaridad, pueden rodear los iones y separarlos, permitiendo que se disuelvan. Imagina que los iones son como personas en un grupo que están siendo empujadas por un grupo de amigos (las moléculas de agua) que las separan para que cada una pueda bailar sola.
Los enlaces de hidrógeno y su importancia
Los enlaces de hidrógeno son otro aspecto fascinante de la solubilidad. Estas son interacciones que ocurren entre moléculas de agua y otras moléculas polares. Cuando una sustancia forma enlaces de hidrógeno con el agua, se vuelve más soluble. Por ejemplo, el alcohol es soluble en agua porque puede formar enlaces de hidrógeno con las moléculas de agua. Es como si el alcohol tuviera una invitación especial para unirse a la fiesta del agua, mientras que las moléculas no polares, como el aceite, no reciben esa invitación.
La influencia del pH en la solubilidad
El pH también puede afectar la solubilidad de ciertas sustancias. ¿Sabías que algunas sustancias son más solubles en ambientes ácidos o básicos? Esto se debe a que el pH puede alterar la carga de las moléculas, afectando su interacción con el agua. Por ejemplo, algunas sales se disuelven mejor en soluciones ácidas que en soluciones neutras, debido a que los protones adicionales en el medio ácido pueden ayudar a romper los enlaces iónicos.
Ejemplos prácticos del pH y la solubilidad
Un ejemplo práctico de esto es el ácido acético (vinagre). Cuando lo añades a agua, se disuelve fácilmente y puede incluso ayudar a disolver otros compuestos. Por otro lado, algunas sustancias como el carbonato de calcio son menos solubles en agua ácida que en agua neutra, lo que puede ser un factor importante a considerar en la química ambiental y la biología.
Aplicaciones de la solubilidad en la vida cotidiana
Ahora que hemos cubierto los factores que influyen en la solubilidad, ¿por qué no explorar algunas aplicaciones prácticas en nuestra vida diaria? Desde la cocina hasta la industria farmacéutica, la solubilidad juega un papel fundamental en muchos aspectos de nuestras vidas.
La cocina: una mezcla de ciencia y arte
Cuando cocinas, la solubilidad es clave. Ya sea que estés preparando un jarabe simple, haciendo una salsa o incluso horneando, entender cómo y por qué ciertos ingredientes se disuelven puede marcar la diferencia entre un plato delicioso y uno mediocre. ¿Alguna vez has intentado disolver azúcar en agua fría? Puede ser un ejercicio frustrante. Sin embargo, calentar el agua puede hacer que el azúcar se disuelva más rápido y de manera más uniforme.
La industria farmacéutica y la formulación de medicamentos
En el mundo de la medicina, la solubilidad es un factor crítico en la formulación de medicamentos. Muchos fármacos deben ser solubles en agua para que el cuerpo pueda absorberlos adecuadamente. Si un medicamento no se disuelve bien, puede no ser efectivo. Por lo tanto, los científicos pasan mucho tiempo investigando cómo mejorar la solubilidad de los fármacos, utilizando diferentes excipientes y métodos de formulación.
¿Por qué el agua es conocida como el «disolvente universal»?
El agua es llamada el «disolvente universal» porque puede disolver más sustancias que cualquier otro líquido. Esto se debe a su polaridad y a su capacidad para formar enlaces de hidrógeno, lo que permite que muchas moléculas se integren en ella.
¿Todos los sólidos son solubles en agua?
No, no todos los sólidos son solubles en agua. La solubilidad depende de la polaridad de las moléculas y de las interacciones que puedan formarse con el agua. Por ejemplo, el azúcar es soluble, mientras que el aceite no lo es.
¿Cómo afecta la presión a la solubilidad de los líquidos?
La presión tiene un efecto menor en la solubilidad de los líquidos en comparación con los gases. Sin embargo, en algunos casos, un aumento de presión puede ayudar a disolver ciertos líquidos, aunque este efecto es más notable en gases.
¿Qué rol juega el pH en la solubilidad de las sustancias?
El pH puede influir en la solubilidad de algunas sustancias, ya que puede alterar la carga de las moléculas y afectar su interacción con el agua. Algunas sustancias son más solubles en ambientes ácidos o básicos.
¿Es posible aumentar la solubilidad de un fármaco?
Sí, hay varias estrategias para aumentar la solubilidad de un fármaco, como la modificación de su estructura química, el uso de excipientes o la formulación de sales, que pueden mejorar su absorción en el cuerpo.
En resumen, la solubilidad en agua es un fenómeno complejo influenciado por diversos factores, desde la polaridad de las moléculas hasta la temperatura y la presión. Entender estos principios no solo es fascinante, sino que también tiene aplicaciones prácticas en la vida cotidiana y en la ciencia. ¿Qué otros aspectos de la solubilidad te gustaría explorar? ¡La química está llena de sorpresas!